详情
摘要
本发明公开了一种高分子聚合物及其制备方法及应用,涉及材料学技术领域。所述方法包括:制备磁性四氧化三铁纳米颗粒;在密闭氮气氛中用硅烷偶联剂改性四氧化三铁纳米颗粒得到改性四氧化三铁纳米颗粒;在密闭氮气氛中用可逆加成断裂链转移聚合法使改性四氧化三铁纳米颗粒、温敏性单体及羟基功能单体反应得到共聚物A;将共聚物A与含有环氧基的固定化靶点单体反应得到高分子聚合物。所述高分子聚合物可作为青霉素酰化酶固定化载体,载体的低临界溶胶/凝胶相转变温度为34‑38℃,表观酶活为14000‑19500U/g、游离酶负载量为30‑210mg/g,酶活回收率为40%‑60%,重复使用10次后,酶活保留率可达到90%。
权利要求
1.一种固定化青霉素酰化酶固定化载体的制备方法,其特征在于,所述方法包括:制备磁性四氧化三铁纳米颗粒:所述磁性四氧化三铁纳米颗粒是采用反相微乳液法制备得到;在密闭氮气氛中用硅烷偶联剂改性所述磁性四氧化三铁纳米颗粒,得到改性四氧化三铁纳米颗粒;所述硅烷偶联剂改性所述磁性四氧化三铁纳米颗粒的最佳条件:所述硅烷偶联剂的浓度为16.000g/L,所述硅烷偶联剂与所述磁性四氧化三铁纳米颗粒的摩尔比为
2.6749:1,反应温度为25℃,反应水/醇比为5%,反应pH为6,反应时间为2.5h;所述硅烷偶联剂为γ―甲基丙烯酰氧基丙基三甲氧基硅烷;在密闭氮气氛中利用可逆加成断裂链转移聚合法使所述硅烷偶联剂改性四氧化三铁纳米颗粒、温敏性单体及羟基功能单体进行共聚反应,得到共聚物A;所述温敏性单体为N,N‑二乙基丙烯酰胺或N‑异丙基丙烯酰胺;所述羟基功能单体为甲基丙烯酸β‑羟乙酯;该共聚物A的具体制备过程:(1)在氮气氛中,将1,4‑二氧六环、三硫代十二烷酸‑2‑氰基异丙酯及所述硅烷偶联剂改性四氧化三铁纳米颗粒进行混合,反应温度为65℃,反应时间为14h,硅烷偶联剂与三硫代十二烷酸‑2‑氰基异丙酯的摩尔比为1:2;反应结束后将混合产物进行磁性分离,并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物1;(2)将1,4‑二氧六环、引发剂、所述产物1及温敏性单体混合后置于65℃恒温水浴中搅拌反应;其中,引发剂、所述产物1和温敏性单体的摩尔比为1:20:1000;反应结束后将混合产物进行磁性分离,并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物2;(3)将1,4‑二氧六环、引发剂、所述产物2及羟基功能单体混合后置于65℃恒温水浴中搅拌反应;其中,引发剂、所述产物2和羟基功能单体的摩尔比为1:20:1000;反应结束后将混合产物进行磁性分离,并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物3,所述产物3即为所述共聚物A;所述1,4‑二氧六环为质量百分比为10%的1,4‑二氧六环溶液;所述引发剂均为偶氮二异丁氰;在密闭氮气氛中将所述共聚物A与含有环氧基的固定化靶点单体和甲基丙烯酸甲酯进行共聚反应,得到共聚物B,即所述固定化青霉素酰化酶固定化载体;所述含有环氧基的固定化靶点单体为甲基丙烯酸缩水甘油酯;所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的混合摩尔比为1‑8:1‑2。
2.一种固定化青霉素酰化酶固定化载体,其特征在于,所述固定化青霉素酰化酶固定化载体是采用权利要求1所述的方法制备得到。
3.一种固定化青霉素酰化酶,其特征在于,所述固定化青霉素酰化酶的固定化载体为采用权利要求1所述的方法制备的固定化青霉素酰化酶固定化载体。
4.权利要求2所述的一种固定化青霉素酰化酶固定化载体在制备固定化青霉素酰化酶中的应用。
说明书
一种高分子聚合物及其制备方法及应用
技术领域
[0001]本发明涉及材料学技术领域,尤其涉及一种高分子聚合物及其制备方法及应用。
背景技术
[0002]固定化酶(Immobilized enzyme)是20世纪60年代发展起来的一种新技术。所谓固定化酶,是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。与游离酶相比,固定化酶在保持其高效、专一及温和的酶催化反应特性的同时,还呈现贮存稳定性高、分离回收容易、可多次重复使用、操作连续及可控、工艺简单等一系列优点,不仅在化学、生物学及生物工程、医学及声明科学等学科领域得到迅速发展。
[0003]根据酶的性质和用途,可通过包埋法、交联法、吸附法及共价结合法来实现酶的固定化。包埋法分为网格型和微囊型两类,其制备工艺简便且条件较为温和、可获得较高的酶活力回收。交联法是游离酶的氨基酸残基与双官能团或多功能团交联剂反应而被固定化、可得酶蛋白单位浓度较高的固定化酶。吸附法包括物理吸附和例子结合法,工艺简单及条件温和,可供选择的载体涉及天然或合成的无机与有机高分子材料、有时酶的纯化与固定化可同时实现。共价结合法因酶分子与载体之间的共价结合而呈现良好的稳定性及重复使用性,是目前研究最活跃的一类酶固定化方法。但前述各种酶固定化方法亦各有不足,该不足限制了固定化酶的广泛应用。尤其在酶法生产6‑氨基青霉素烷酸(6‑Aminopenicillanic acid,6‑APA)工艺中,其核心问题是高效固定化青霉素酰化酶(Penicillin G acylase,PGA)的制备技术,而载体材料的设计与制备是PGA固定化技术的关键所在。
[0004]因此,亟需研制一种酶活回收率高、具有适宜的低临界溶胶/凝胶相转变温度(Lower critical solution temperature,LCST)的新型磁性兼温敏性酶固定化载体。
发明内容
[0005]有鉴于此,本发明实施例提供了一种高分子聚合物及其制备方法及应用。
[0006]为达到上述目的,本发明主要提供了如下技术方案:
[0007]一方面,本发明实施例提供了一种高分子聚合物的制备方法,所述方法包括以下步骤:制备磁性四氧化三铁纳米颗粒;在密闭氮气氛中用改性剂改性所述磁性四氧化三铁纳米颗粒,得到改性四氧化三铁纳米颗粒;在密闭氮气氛中利用可逆加成断裂链转移聚合法使所述改性四氧化三铁纳米颗粒、温敏性单体及羟基功能单体进行共聚反应,得到共聚物A;在密闭氮气氛中将所述共聚物A与含有环氧基的固定化靶点单体进行反应,得到共聚物B,即所述高分子聚合物。
[0008]作为优选,所述磁性四氧化三铁纳米颗粒是采用反相微乳液法制备得到;所述改性剂为油酸、油酸钠、盐酸、羊毛纤维降解液、淀粉、阳离子表面活性剂、钛酸酯偶联剂或硅烷偶联剂;所述硅烷偶联剂为γ―甲基丙烯酰氧基丙基三甲氧基硅烷;所述温敏性单体为N,N‑二乙基丙烯酰胺或N‑异丙基丙烯酰胺;所述羟基功能单体为甲基丙烯酸β‑羟乙酯、丙烯酸或甲基丙烯酸甲酯;所述含有环氧基的固定化靶点单体为甲基丙烯酸缩水甘油酯与甲基丙烯酸甲酯的共聚物,或甲基丙烯酸缩水甘油酯。
[0009]作为优选,所述硅烷偶联剂改性所述磁性四氧化三铁纳米颗粒的最佳条件:所述硅烷偶联剂的浓度为16.000g/L,所述硅烷偶联剂与所述磁性四氧化三铁纳米颗粒的摩尔比为2.6749:1,反应温度为20℃,反应水/醇比为5%,pH为6,反应时间为2.5h;反应结束后将混合产物进行磁性分离,取上清液测其吸光度,将取上清液后的产物用无水乙醇洗至中性并放入45℃的真空干燥箱进行干燥,干燥后的固体产物即为所述改性四氧化三铁纳米颗粒。
[0010]作为优选,所述共聚物A的具体制备过程:
[0011](1)在氮气氛中,将1,4‑二氧六环、所述硅烷偶联剂、三硫代十二烷酸‑2‑氰基异丙酯及所述改性四氧化三铁纳米颗粒进行混合,反应温度为65℃,反应时间为14h,所述硅烷偶联剂与三硫代十二烷酸‑2‑氰基异丙酯的摩尔比为1:2;反应结束后将混合产物进行磁性分离,取上清液测其吸光度,将取上清液后的产物用无水乙醇洗至中性并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物1;
[0012](2)将1,4‑二氧六环、引发剂、所述产物1及温敏性单体混合后置于70℃恒温水浴中搅拌反应;其中,引发剂、所述产物1和温敏性单体的摩尔比为1:20:1000;反应结束后将混合产物进行磁性分离,取上清液测其吸光度,将取上清液后的产物用无水乙醇洗至中性并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物2;
[0013](3)将1,4‑二氧六环、引发剂、所述产物2及羟基功能单体混合后置于70℃恒温水浴中搅拌反应;其中,引发剂、所述产物2和羟基功能单体的摩尔比为1:20:1000;反应结束后将混合产物进行磁性分离,取上清液测其吸光度,将取上清液后的产物用无水乙醇洗至中性并放入45℃的真空干燥箱进行干燥,干燥后的固体产物为产物3,所述产物3即为所述共聚物A。
[0014]作为优选,所述共聚物B的具体制备过程:将所述产物3、所述含有环氧基的固定化靶点单体和甲基丙烯酸甲酯进行共聚反应,得到产物4,即为所述高分子聚合物。
[0015]作为优选,所述1,4‑二氧六环为质量百分比为10%的1,4‑二氧六环溶液;所述硅烷偶联剂为γ―甲基丙烯酰氧基丙基三甲氧基硅烷;所述引发剂为偶氮二异丁氰;所述温敏性单体为N,N‑二乙基丙烯酰胺;所述羟基功能单体为甲基丙烯酸β‑羟乙酯;所述含有环氧基的固定化靶点单体为甲基丙烯酸缩水甘油酯,或所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的共聚物,所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的混合摩尔比为1‑8:1‑2。
[0016]作为优选,所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的混合摩尔比为1:1。
[0017]作为优选,所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的混合摩尔比为5:2。
[0018]作为优选,所述甲基丙烯酸甲酯与所述甲基丙烯酸缩水甘油酯的混合摩尔比为7:2。
[0019]另一方面,本发明实施例提供了一种高分子聚合物,其是由上述方法制备得到。
[0020]再一方面,本发明实施例提供了一种固定化青霉素酰化酶固定化载体,即上述高分子聚合物。
[0021]又一方面,本发明实施例提供了一种固定化青霉素酰化酶,所述固定化青霉素酰化酶的固定化载体为上述高分子聚合物。
[0022]又一方面,本发明实施例提供了上述高分子聚合物在制备固定化青霉素酰化酶中的应用。
[0023]与现有技术相比,本发明的有益效果是:
[0024]本发明通过硅烷偶联剂改性四氧化三铁纳米颗粒、RAFT试剂、温敏性单体、羟基功能单体及含环氧基靶点单体共聚反应后获得一种磁性兼温敏性高分子聚合物。所述高分子聚合物可作为青霉素酰化酶(PGA)固定化载体;所述固定化载体的低临界溶胶/凝胶相转变温度(LCST)为34‑38℃,所述固定化PGA的表观酶活(固定于载体上的单位质量的酶活力)为14000‑19500U/g、游离酶负载量(被固定到载体上的游离酶量)为30‑210mg/g,酶活回收率大致范围为40%‑60%,重复使用10次后,所述酶活保留率可达到90%。
附图说明
[0025]图1是本发明实施例提供的硅烷偶联剂改性FeO纳米颗粒的流程图;
[0026]图2是本发明实施例提供的改性FeO纳米颗粒上清液技术处理流程图;
[0027]图3是本发明实施例提供的无规共聚物P(MMA‑co‑GMA)的竞聚率回归方程曲线图;
[0028]图4是本发明实施例提供的6‑APA(6‑氨基青霉素酸)标准曲线图;
[0029]图5是本发明实施例提供的固定化PGA流程图。
具体实施方式
[0030]为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下以较佳实施例,对依据本发明申请的具体实施方式、技术方案、特征及其功效,详细说明如后。下述说明中的多个实施例中的特定特征、结构、或特点可由任何合适形式组合。
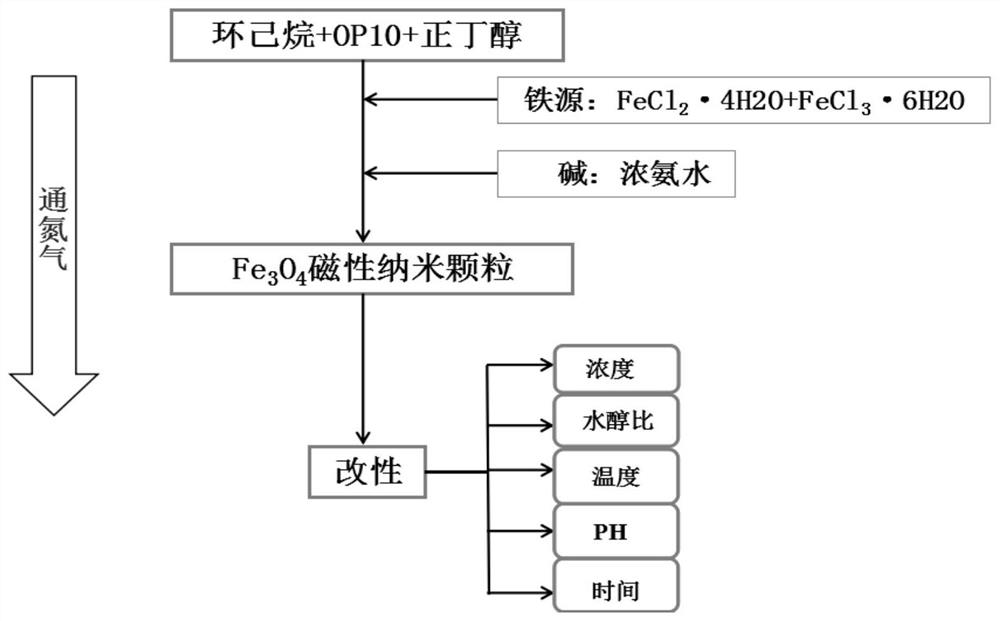
[0031]本发明涉及的专业术语解释如下:
[0032]反相微乳液法(Reversed‑phase microemulsion method):是近几年才发展起来的制备材料的新方法,通过寻找一种或多种微乳液的配制方法来合成出不同尺寸和形状的粒子,从而得到所需性质的相关材料的一种材料制备方法;
[0033]RAFT:是可逆加成‑断裂链转移聚合(Reversible Addition‑Fragmentation Chain Transfer Polymerization)的简称,是活性/可控自由基聚合(CRP)的一种;
[0034]LCST:低临界溶解温度/最低共溶温度。具体指形成部分互溶物系的两种液体,随着温度的降低,二液体的相互溶解度增加;互相平衡的二液相的组成逐渐接近,当降低至某一温度时,二液相组成相同,二液相间的界面消失,在该温度以下,只有一个均匀液相;
[0035]6‑APA:6‑氨基青霉素烷酸;
[0036]PGA:固定化青霉素酰化酶;
[0037]KH‑570:γ―甲基丙烯酰氧基丙基三甲氧基硅烷;
[0038]CPDTC:RAFT试剂,三硫代十二烷酸‑2‑氰基异丙酯;
[0039]AIBN:偶氮二异丁氰;
[0040]DEA:N,N‑二乙基丙烯酰胺;
[0041]HEMA:甲基丙烯酸β‑羟乙酯;
[0042]MMA:甲基丙烯酸甲酯;
[0043]GMA:甲基丙烯酸缩水甘油酯。
[0044]实施例1(制备高分子聚合物和固定化PGA)
[0045]制备高分子聚合物:
[0046]1)硅烷偶联剂KH‑570浓度为16.000g/L,反应温度为25℃,反应水/醇比为5%,反应pH为6,反应时间为2.5h对FeO纳米颗粒进行改性研究(体系保证密闭且给予恒速N供应);反应结束后,将反应瓶置于磁铁上静置过夜,取上清液做有关技术处理后做吸光度测定,产物用无水乙醇洗至中性并放入45℃真空干燥箱干燥,待干燥完全,得到改性后FeO纳米颗粒,密封保存;
[0047]2)1,4‑二氧六环为溶剂,反应温度为65℃,反应时间为14h,摩尔比n(KH‑570):n(CPDTC)=1:2,用RAFT试剂(三硫代十二烷酸‑2‑氰基异丙酯(Trithiododecanodi‑2‑cyanisopropyl,CPDTC)对步骤1)中得到的改性Fe3O4磁性纳米颗粒进行RAFT试剂化研究(体系保证密闭且给予恒速N供应);反应结束后,试剂化产物磁致分离后放入45℃真空干燥箱干燥,待干燥完全,得到试剂化后的FeO纳米颗粒(定义为产物1),密封保存。
[0048]3)将偶氮二异丁氰(Azo diisobutyl cyanide,AIBN)、试剂化后的FeO纳米颗粒(产物1)、温敏性单体N,N‑二乙基丙烯酰胺(N,N‑diethylacrylamide,DEA)以摩尔比为1:20:1000和1,4二氧六环溶剂(配制质量百分浓度10%的溶液)混合,置于65℃恒温水浴锅中搅拌反应一定时间(体系保证密闭且给予恒速N供应);反应结束后,将将粗产品同步骤2)处理,得到一定分子量的温敏性大分子聚合物RAFT试剂(定义为产物2);
[0049]4)将AIBN、温敏性大分子聚合物RAFT试剂(产物2)和提供微环境的功能单体甲基丙烯酸β‑羟乙酯(Hydroxyethyl methacrylate,HEMA)以摩尔比为1:20:1000和1,4二氧六环为溶剂(配制质量百分比浓度为10%的溶液)混合,置于65℃恒温水浴锅中搅拌反应一定时间(体系保证密闭且给予恒速N供应);反应结束后,将产物粗产品同步骤2)处理,得到二嵌段共聚物(定义为产物3);
[0050]5)将所得二嵌段共聚物(产物3)与以甲基丙烯酸甲酯(Methyl methacrylate,MMA)和甲基丙烯酸缩水甘油酯(Glycidyl methacrylate,GMA)混合进行无规共聚,即得三嵌段共聚物(定义为产物4),命名为PDEA‑b‑HEMA‑b‑P(MMA‑co‑GMA);其中,甲基丙烯酸甲酯与甲基丙烯酸缩水甘油酯的摩尔比为0;
[0051]将上述高分子聚合物作为固定化载体,制备固定化酶:
[0052]称取一定量上述合成的三嵌段共聚物载体(产物4),加入到给定反应器中,再加入60倍载体质量的1%的游离PGA酶液(即将复合载体作为酶的固定化载体固定游离酶,加入的游离酶的质量是复合载体质量的60倍,游离酶的浓度为1%),密封,在37℃条件下避光震荡24小时;分离游离酶残夜,固定化PGA用磷酸盐缓冲液冲洗,直到洗涤液中加入青霉素G,并用PDAB(p‑dimethylaminobenzaldehyde,PDAB)显色给定时间后,测得溶液的吸光度小于
0.005为止;放入37℃真空烘箱干燥至恒重,称重,得上述固定化PGA;
[0053]经过检测,上述固定化PGA的LCST为37℃,固定化酶的表观活力为14017U/g,对应游离酶负载量为201mg/g,酶活回收率为41.87%;经过实验,重复使用10次后,所述酶活保留率可达到90%。
[0054]实施例2
[0055]本实施例2与实施例1不同之处在于,PDEA‑b‑HEMA‑b‑P(MMA‑co‑GMA)中,甲基丙烯酸甲酯与甲基丙烯酸缩水甘油酯的摩尔比为1:1;
[0056]经过检测,上述固定化PGA的LCST为36℃,固定化酶的表观活力为15639U/g,对应游离酶负载量为89mg/g,酶活回收率为46.72%,重复使用10次后,所述酶活保留率可达到90%。
[0057]实施例3
[0058]本实施例3与实施例1不同之处在于,PDEA‑b‑HEMA‑b‑P(MMA‑co‑GMA)中,甲基丙烯酸甲酯与甲基丙烯酸缩水甘油酯的摩尔比为5:2;
[0059]经过检测,上述固定化PGA的LCST为36℃,固定化酶的表观活力为17916U/g,对应游离酶负载量为54mg/g,酶活回收率为53.53%,重复使用10次后,所述酶活保留率可达到90%。
[0060]实施例4
[0061]本实施例3与实施例1不同之处在于,PDEA‑b‑HEMA‑b‑P(MMA‑co‑GMA)中,甲基丙烯酸甲酯与甲基丙烯酸缩水甘油酯的摩尔比为7:2;
[0062]经过检测,上述固定化PGA的LCST为36℃,固定化酶的表观活力为19211U/g,对应游离酶负载量为33mg/g,酶活回收率为57.40%,重复使用10次后,所述酶活保留率可达到90%。
[0063]在上述实施例1‑4中,改性四氧化三铁纳米颗粒的改性剂除了硅烷偶联剂外,还有油酸,油酸钠,盐酸,羊毛纤维降解液,淀粉,阳离子表面活性剂,钛酸酯偶联剂等;优选硅烷偶联剂KH‑570。
[0064]在上述实施例1‑4中,上述温敏性单体还可以使用N‑异丙基丙烯酰胺;但本发明实施例选择N,N‑二乙基丙烯酰胺,是因为其生物相容性好且其低临界相转变温度高,较N‑异丙基丙烯酰胺性能优异。
[0065]在上述实施例1‑4中,上述羟基功能单体(第一个单体)可以是丙烯酸,也可以是甲基丙烯酸甲酯;当上述羟基功能单体(第二个单体)是甲基丙烯酸甲酯的情况下,上述含有环氧基的固定化靶点单体(第三个单体)为甲基丙烯酸甲酯和甲基丙烯酸缩水甘油酯的共聚物;但为了能够更好的构建载体微环境,本发明研究需要寻找一个具有亲水基团且多羟基的单体作为第二个单体,因为载体微环境对酶的固定化影响极大;固定化靶点单体不一定必须为甲基丙烯酸缩水甘油酯,只要是带有能够与酶的氨基共价结合的活性基团的单体均可。
[0066]在上述实施例1‑4中,步骤(5)制备共聚物B时加入甲基丙烯酸甲酯,是因为在只有甲基丙烯酸缩水甘油酯作为靶点固定单体的情况下,酶活会有下降的趋势,所以通过甲基丙烯酸缩水甘油酯和甲基丙烯酸甲酯的无规共聚可以使复合载体靶点间距增大。
[0067]在上述实施例1‑实施例4的合成过程中,依据以下计算方法对各过程产物进行检测计算:
[0068]1、改性FeO纳米颗粒的检测:
[0069]1)利用硅钼蓝显色法在UV上对KH‑570标准液进行全波长扫描,确定KH‑570的最大吸收波长(λ );其次在λ 处建立KH‑570浓度与吸光度之间的线性关系曲线;待反应结束max max后,将三口瓶置于磁铁上静置,磁致分离后,将上清液做有关技术处理后,以V(水)/V(乙醇)=1:1为空白,采用硅钼蓝显色法在λ 下测定反应后残液的吸光度,然后根据标准方程(1)max计算残液中KH‑570的浓度,并按接枝率计算公式确定KH‑570相对FeO的接枝率、接枝率Gr按以下公式(2)计算:
[0070]A=0.03911C‑0.0409,R=0.9996 (1)
[0071]‑1
[0072]其中Gr(%)为KH‑570的接枝率(g/g);C(g·L )为硅烷偶联剂原液中KH‑570浓度‑1(g/L);C(g·L )为硅烷偶联剂残液中KH‑570的浓度(g/L),V为原液体积(mL),m为FeO的干重(g)。
[0073]2、对改性前后FeO纳米颗粒分别进行了透射电镜(TEM)、傅里叶变换红外光谱(FTIR)、X射线衍射(XRD)、饱和磁化强度(VSM)、电感耦合等离子体光谱(ICP)等表征。2、试剂化FeO纳米颗粒(产物1)的检测:
[0074]1)反应结束后,将产物磁致分离,并测量上清液稀释到线性范围内的吸光度,并按(4)式计算接枝率。
[0075]A=15.10491C+0.03827 (3)
[0076]
[0077]其中,A代表吸光度,Gr代表RAFT试剂接枝率(%),C0和C1分别代表RAFT试剂的原液浓度、残液浓度(g/L)。
[0078]2)对试剂化前后FeO纳米颗粒分别进行了透射电镜(TEM)、傅里叶变换红外光谱(FTIR)、X射线衍射(XRD)、饱和磁化强度(VSM)、电感耦合等离子体光谱(ICP)等表征。
[0079]3、单体MMA和GMA的竟聚率比较:
[0080]对无规共聚物P(MMA‑co‑GMA)进行氢谱测定,并根据公式(5)计算竞聚率,为后续更好的选择酶固定化的靶点做基础。
[0081]
[0082]其中,dx/dx是共聚物中单体单元MMA和GMA的摩尔比,x/x是单体MMA和单体GMA的摩尔比,r、r分别是单体MMA和单体GMA的竞聚率。
[0083]4、嵌段共聚物温敏性检测:
[0084]将嵌段共聚物样品配制成浓度为0.01mg/mL的极稀水溶液,静态荧光光谱检测,表征其温敏性(LS‑55型荧光光谱分析仪,美国Perkin‑Elmer公司。检测条件为:激发波长290nm,扫描速度240nm/min,激发、发射狭缝均为10nm,扫描发射光波长范围330nm‑430nm,在380nm处测荧光强度)。
[0085]5、青霉素酰化酶的固定化及酶活力、酶负载量、酶活回收率的测定:
[0086]1)固定化:称取上述实施例4合成的固定化载体,加入到反应器中,再加入60倍载体质量的1%(原酶溶液按体积比稀释至1%)的游离PGA酶液,密封,在37℃条件下避光震荡24小时;分离游离酶残夜,固定化PGA用磷酸盐缓冲液冲洗,直到洗涤液中加入青霉素G,并用PDAB显色3min后,测的溶液的吸光度小于0.005为止;放入37℃真空烘箱干燥至恒重,得固定化PGA。
[0087]2)酶活力、酶负载量、酶活回收率的测定:将一定量固定化PGA与1%(wt%)的50倍量的青霉素G钾反应5分钟,将反应液稀释一定倍数。取上清液0.1mL,加入3.5mL PDAB液显色3分钟后,通过PDAB显色法测定6‑APA的含量,依式(6)、(7)、(8)计算酶活力、酶负载量、酶活回收率
[0088]
[0089]AC=a ‑a (7)v0 v
[0090]
[0091]式中,a代表固定化PGA酶活力(U/g),C代表6‑APA浓度(mM),V代表6‑APA体积g(mL),m代表PGA质量(g),t代表固定化PGA与底物反应时间,AC代表酶负载量,av代表原液酶活力(U/mL),a代表固定化残液酶活力(U/mL),AR代表酶活回收率;V代表用于固定化PGAv 1的酶液体积。
[0092]本发明实施例中未尽之处,本领域技术人员均可从现有技术中选用。
[0093]以上公开的仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以上述权利要求的保护范围为准。


